1. 緒言
心疾患は、厚生労働省令和2年人口動態統計[1]において、男女ともに死因の第2位を占めている。その中でも虚血性心疾患の割合は高く、心疾患による死亡の42%を占めている[2]。さらに、WHOのGDB2017調査によれば、虚血性心疾患は全死亡の15.96%を占め、世界においても人々の生命を脅かす病気となっている[3]。
虚血性心疾患の代表である心筋梗塞は、近年、治療法の進歩により急性期死亡率が著しく改善している[4]。しかし、左室リモデリングを生じた慢性心不全症例の増加から、健康寿命が改善されていないことが指摘されており[5]、患者の日常生活活動(ADL)や生活の質(QOL)の保持が課題となっている。また、心筋梗塞は再発率が高く、約27~40%の患者が治療後3年以内に心血管関連イベントを再び起こしている[6]。心筋梗塞の繰り返しは慢性心不全を引き起こす原因となる。症状が進んだ重症心不全の根本治療は心臓移植であるが、日本の移植件数は諸外国と比べて少なく、2010年の臓器移植法改正後も、実際に移植を受けられるのは希望者の10人に1人にとどまっている[7]。そのため、重症心不全になる前に病気の進行を抑えることが重要である。
そこで、本研究では、虚血状態において、心筋細胞の壊死を減らして心筋梗塞を防ぐことができる新しい治療法を提案することとした。
2. 背景
2.1. 心筋梗塞と血管関連イベント
心筋梗塞は、心臓を養う血管である冠動脈が閉塞して心筋が酸素不足になり、壊死して起こる。冠動脈閉塞の原因の大部分は動脈硬化であり、血管の内側にたまったコレステロールのかたまりであるプラークが破裂し、その周囲に血栓ができて血管がふさがれることにより起こる[2]。
2.2. 心不全の臨床経過
心筋梗塞を発症すると、心筋の一部が壊死して動かなくなる。この壊死した部位を梗塞部位という。梗塞部位が大きいほど心臓のポンプ機能の低下が顕著になり、心不全を起こしやすくなる。
心不全とはすべての心臓病が行きつく終末像である。心不全は心筋梗塞などの急性憎悪を繰り返しながら進行し、末期に至る[8]。心筋梗塞を繰り返すということは、心臓の梗塞部位がそのたびに広がるということである。もともと弱ったポンプ機能が「更に」、「急に」低下することになるため、回数を重ねるごとに死亡のリスクが上がっていく。
2.3. 虚血性心疾患の治療
急性心筋梗塞の治療では、冠動脈を閉塞している血栓を血栓溶解薬の注射で溶かすt-PA (tissue plasminogen activator)静注療法やカテーテルを使って閉塞を解消する冠動脈血行再建法(カテーテル・インターベンション)、外科的治療として冠動脈バイパス術など適切な再灌流療法を施行してできるだけ早期に心筋虚血を解除する。同時にACE(アンジオテンシン変換酵素)阻害剤を投与して血管を拡張させ、心臓の負担を下げて左室のリモデリングを防止する[8]。
慢性の虚血性心不全の治療としては、主に薬物療法と生活習慣病を改善するための運動・食事療法が行われる。薬物療法では、ACE阻害剤やβ遮断薬により血圧、心拍数を下げて心筋を保護する。また、次の心血管関連イベント予防のため、血液をサラサラにする抗血小板凝集薬やLDLコレステロールを下げる脂質改善薬が投与される[8]。
3. 提案
3.1. 心筋を虚血に強くする方法
心筋に低酸素耐性を付与することによって、虚血による心筋細胞の壊死を減らすことができ、心筋梗塞の発生と心不全の進行を抑制することができるのではないかと考えた。
本研究では、低酸素状態に強い細胞を作り出すために、標高が高い地域で生活する人々に着目した。 超高地では、人々は低酸素状態に日常的にさらされている。例えば標高5,000 mでは気圧は540.2 hPaしかなく、したがって空気中の酸素分圧は53%程度である。海抜0 mでの大気中酸素濃度を100%とすると、5,000 mの高地では平地の約半分の酸素濃度しかない[9]。超高地において驚異的なパフォーマンスを発揮し、長くヒマラヤ登山隊を支えてきたネパールのシェルパ族を対象とした研究[9, 10]において、彼らの血中酸素飽和度は標高が低い地域で暮らす「低地人」が高地にいる場合と同程度であることが示されている。それにも関わらず高い運動パフォーマンスを発揮できる理由として、彼らのミトコンドリアがATPを生成してエネルギーを得る際、「低地人」に比べて酸素をより効率的に使用できることが明らかになっている[10]。本稿では以後、シェルパ族のミトコンドリアを「低酸素耐性ミトコンドリア」とする。
本研究では虚血性心疾患の患者また高リスク者の心筋細胞に対し、低酸素耐性ミトコンドリアを移植することで虚血状態への耐性を付与することを考案した。
3.2. ミトコンドリアの移植方法
ミトコンドリア病の女性の卵子に正常なミトコンドリアを導入する生殖細胞のミトコンドリア置換はすでに実用段階にある[11]。しかし、体細胞へのミトコンドリア移植はin vitroの研究[12]がほとんどで、臨床研究[13]はまだ少数である。生殖細胞とは異なり、多くの細胞にミトコンドリアを届けなければならないことが課題となっている。
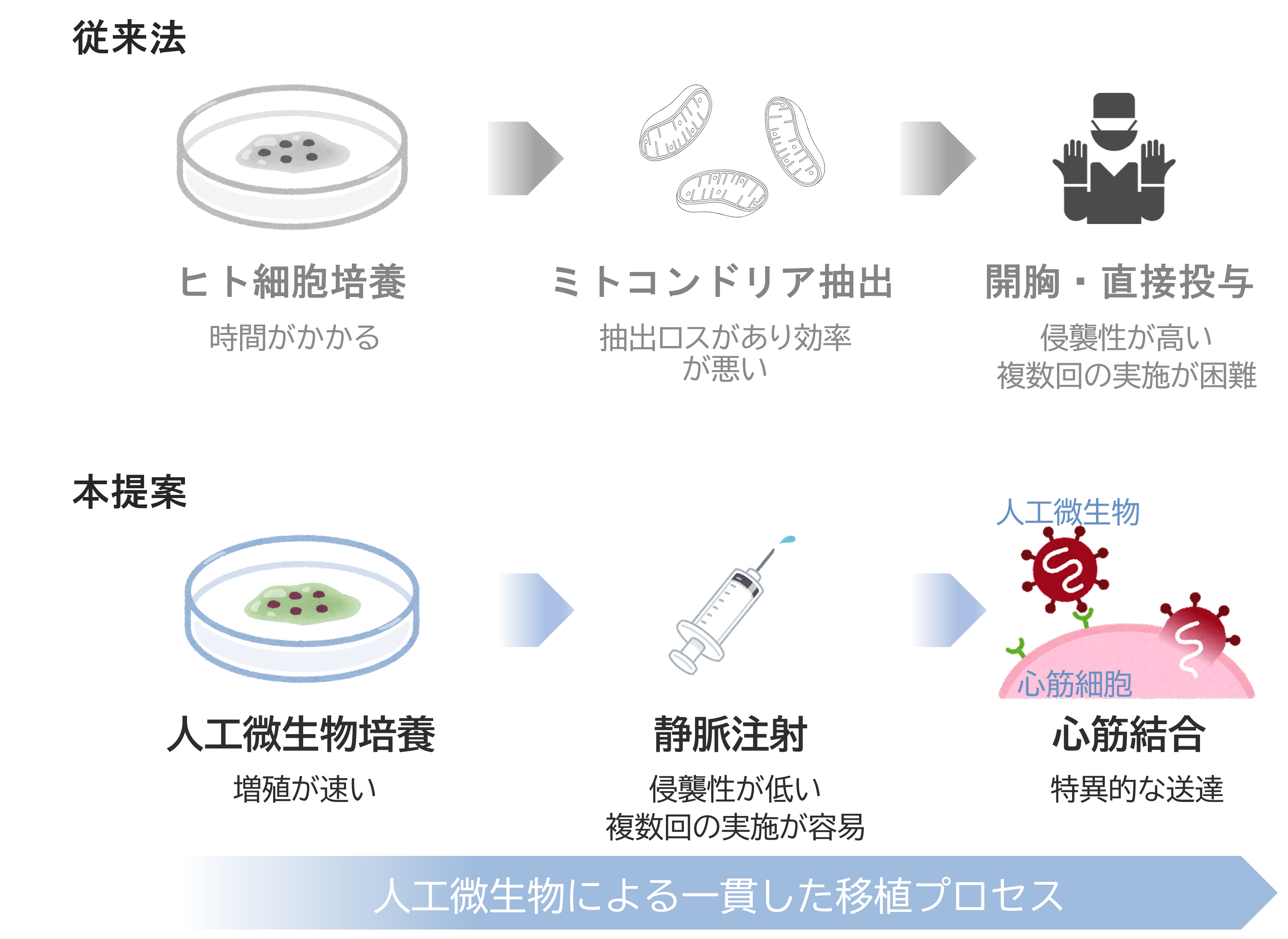
図1. 上に既存のミトコンドリア移植法[14]を、下に本提案の移植法を示す。既存の方法では、まずドナーまたは患者本人の細胞を培養する。次に培養した細胞からミトコンドリアを抽出して心筋など移植したい臓器に与える。ミトコンドリアの抽出は細胞をすりつぶした後、高速遠心による沈殿と再懸濁によって行われるが、その過程でミトコンドリアが損傷して活性が低くなったり、数が減ったりすることが課題となっている[15]。移植にあたっては外科的手法によって組織に直接ミトコンドリア溶液をかけなければならないことから、侵襲性が高く、何度も行うことが困難である。ミトコンドリアを血管から注入する方法も考えられるが、ミトコンドリアは細胞外で長く生きていくことができず、かつ全身に広がるため、心筋へ効率的に送達することは困難である。
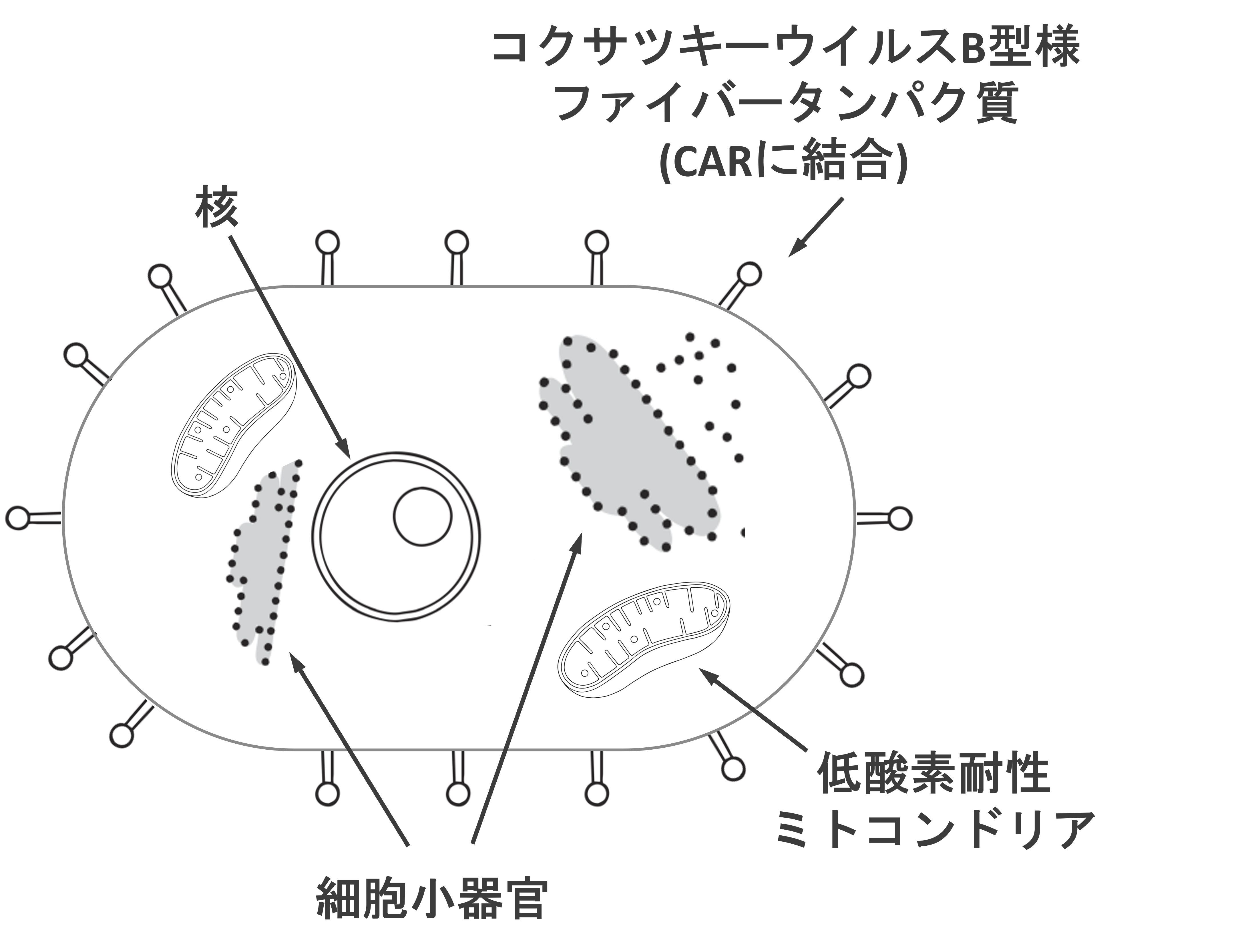
上記課題を解決するため、本研究では低酸素耐性ミトコンドリアの培養とデリバリーを共通の機能性人工微生物によって行うことを提案する。図2. に本研究の機能性人工微生物の概要を示す。この機能性人工微生物は、真核生物の細胞小器官を備えることで分裂と同時にミトコンドリアを増やすことができ、ウイルス様の外膜を備えることで特定の組織に侵入できるようなものを考えている。
3.3. 心筋にミトコンドリアをデリバリーする方法
ウイルスは、細胞膜に存在する受容体を介して感染する。1976年、 Lonberg-Holmらが、異なるウイルスファミリーに属するコクサツキーウイルスB型と、アデノウイルスの2型と5型が、共通の膜受容体に結合することを報告した[16]。この共通膜受容体はCoxsackievirus and Adenovirus Receptor(CAR)と命名され、多くの研究者によってその生物学的機能の解析が進められてきた[17]。
コクサツキーウイルスとアデノウイルスはカプシドの外側にあるファイバータンパク質を介して、宿主細胞に存在する受容体CARと結合することにより、細胞表面に吸着して細胞内部に侵入する。CARは心臓や脳などいくつかの組織で発現しており、心筋炎などの病因となることが知られている。
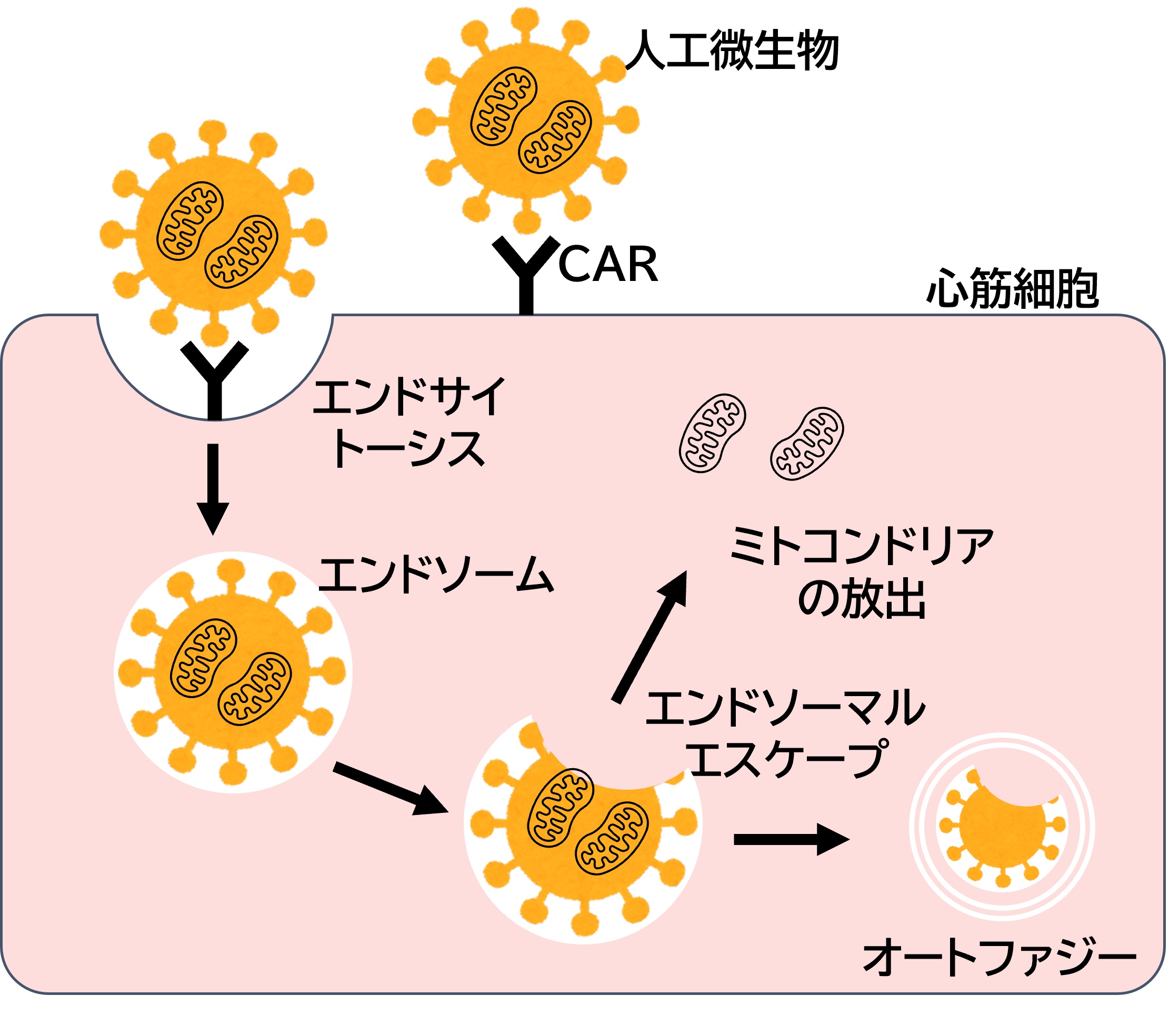
本研究では、図2. に示したようなコクサツキーウイルスB型様外膜を持つ人工微生物を静脈注射することにより、低侵襲にミトコンドリアを心筋にデリバリーできるのではないかと考えた。図3. に本研究の人工微生物が細胞内にミトコンドリアを届けるまでのプロセスを示す。人工微生物は外側にあるファイバータンパク質を介して、宿主細胞に存在する受容体CARと結合する。その後、ファイバーの根本のペントンベースにあるRGDというアミノ酸配列が、細胞表面の接着分子インテグリンと結合し、この複合体がエンドサイトーシスされて細胞内に入る。次に、エンドソーマルエスケープによりエンドソーム膜の中からミトコンドリアが放出されて移植が完了する。細胞内に残った人工微生物の外膜、細胞小器官はオートファジーにより分解される。
3.4. 合成生物学による人工微生物の創造
合成生物学(Synthetic Biology)はバイオテクノロジー領域における世界的な研究トレンドの一つになっている。「生命のプログラム」であるゲノムの網羅的解析が可能になったことにより、生物の構成要素とその機能、およびゲノム情報を組み合わせて、生物を人工的に「創る」ことが可能になると考えられている。実際に、2010年にはCraig Venterらが、細菌の一種であるマイコプラズマの全ゲノムを化学合成し、その合成ゲノムを近縁種の別のマイコプラズマに移植したところ、合成ゲノムの情報に基づいてタンパク質を作り、生きた細菌として分裂や増殖も始めたという研究を発表し、世界の注目を集めた[18]。
今後の合成生物学の発展により、生命機能を人工的にデザイン・構築することが可能となり、本研究の機能性人工微生物が実現すると考えている。
3.5. 治療の全体像
最後に治療の全体像について説明する。 まず、低酸素耐性ミトコンドリアを導入した機能性人工微生物を培養する。人工微生物の分裂とともにミトコンドリアも半自動増殖する。患者に培養した人工微生物を静脈注射する。人工微生物はCARを介して心筋細胞表面に吸着し、細胞内に侵入する。細胞内に侵入した人工微生物からミトコンドリアが放出され、移植が完了する。最終的に、細胞内に移植された低酸素耐性ミトコンドリアにより心筋細胞が虚血状態に強くなり、心筋梗塞の発生が抑制される。
4. 課題と展望
4.1. 人工微生物の病原性
体内で人工微生物が増殖した場合、敗血症など重篤な症状が引き起こされる可能性がある。高温菌や低温菌のようにヒトの体温とは異なる温度で増殖する性質を人工微生物に付与することにより、体内での増殖を不可能とする方法が考えられる。また、特定の薬剤に対する感受性を高めておくことで迅速に体内から排除できるようにする方法も考えられる。
4.2. デリバリーの精度
本提案において人工微生物がターゲットとするのは膜受容体CARである。CARは心筋細胞以外に脳や上皮細胞の一部にも発現しているため、ターゲット外の組織へもミトコンドリアがデリバリーされる可能性がある。CARへの結合に際し、心筋細胞に高度に発現する膜貫通セリンプロテアーゼ、コリン[19]によるファイバータンパク質の開裂を必要とするように人工微生物を設計することで、より心筋細胞に限定的にミトコンドリアをデリバリーさせる方法が考えられる。
4.3. 展望
人工微生物のベクターであるファイバータンパク質を変更することで、虚血によって尿細管上皮細胞の剥離脱落が起こる虚血性尿細管間質性障害に対する治療に適応できる可能性がある。また、T細胞のミトコンドリア活性化によりがんに対する免疫応答の効果が高まることが報告されている[20]ことから、がん治療への応用も期待できる。対象が免疫細胞の場合、貪食作用があるためより簡単にデリバリーが可能である。
5. 結論
本研究では、超高地で生活する人々の持つ低酸素耐性ミトコンドリアを、真核生物の細胞小器官とコクサツキーウイルスB型様外膜を併せ持つ機能性人工微生物によって心筋細胞に移植し、低酸素耐性を付与する方法を考案した。心筋に低酸素耐性を持たせることで、虚血による細胞の壊死を防ぎ、心筋梗塞を抑制できることを見込んでいる。また、侵襲性が低い機能性人工微生物によるミトコンドリア移植により、心筋梗塞を一度も発症したことがない高リスク者に対する予防的介入にも適用できることを期待している。
6. 参考文献
[1] 厚生労働省: 令和2年(2020)人口動態統計(確定数)の概況.
[2] 2011年度合同研究班: 虚血性心疾患の一次予防ガイドライン. 2012.
[3] F. Wang et al.: Global Burden of Ischemic Heart Disease and Attributable Risk Factors, 1990–2017: A Secondary Analysis Based on the Global Burden of Disease Study 2017. Clin Epidemiol, vol. 13, pp. 859–870, Sep. 2021.
[4] https://www.ncvc.go.jp/hospital/section/cvm/coronary/pro-12/ (2022年7月18日)
[5] 伊藤浩, 山下武志 (編): 循環器疾患最新の治療2020-2021. 南江堂, 2020.
[6] M. Ishihara et al., “Long-Term Outcomes of Non-ST-Elevation Myocardial Infarction Without Creatine Kinase Elevation ― The J-MINUET Study ―,” Circulation Journal, vol. 81, no. 7, pp. 958–965, 2017.
[7] 日本心臓移植研究会: 日本における心臓移植報告. 2021.
[8] 日本循環器学会: 急性・慢性心不全診療ガイドライン (2017年改訂版). 2018.
[9] 長嶺信夫: チベット高地における血中酸素飽和度について ~日本人旅行者およびチベット人の興味深い測定結果~. 沖縄医報, Vol. 47, No. 10, 2011.
[10] J. A. Horscroft et al.: Metabolic basis to Sherpa altitude adaptation,” Proc Natl Acad Sci U S A, vol. 114, no. 24, pp. 6382–6387, Jun. 2017.
[11] https://www.nikkei.com/article/DGXLASDG29HDW_Z20C16A8CR8000/ (2022年7月18日)
[12] H. Maeda et al.: Generation of somatic mitochondrial DNA-replaced cells for mitochondrial dysfunction treatment. Sci Rep, vol. 11, no. 1, Art. no. 1, May 2021.
[13] S. M. Emani et al.: Autologous mitochondrial transplantation for dysfunction after ischemia-reperfusion injury. J Thorac Cardiovasc Surg, vol. 154, no. 1, pp. 286–289, Jul. 2017.
[14] D. Liu et al.: Intercellular mitochondrial transfer as a means of tissue revitalization. Sig Transduct Target Ther, vol. 6, no. 1, pp. 1–18, Feb. 2021.
[15] 貴弘柴田, 紗季山下, 薫加藤, 善浩太田: ダメージの少ないミトコンドリア単離法. 生物物理, vol. 56, no. 2, pp. 112–115, 2016.
[16] K. Lonberg-Holm et al.: Unrelated animal viruses share receptors. Nature, vol. 259, no. 5545, pp. 679–681, Feb. 1976.
[17] V. G. Khurana and F. B. Meyer: Translational Paradigms in Cerebrovascular Gene Transfer. J Cereb Blood Flow Metab, vol. 23, no. 11, pp. 1251–1262, Nov. 2003.
[18] https://www.science.org/doi/10.1126/science.1190719 (2022年7月18日)
[19] J. D. Hooper et al.: Localization of the mosaic transmembrane serine protease corin to heart myocytes. Eur J Biochem, vol. 267, no. 23, pp. 6931–6937, Dec. 2000.
[20] M. Malinee et al.: Targeted epigenetic induction of mitochondrial biogenesis enhances antitumor immunity in mouse model. Cell Chem Biol, vol. 29, no. 3, pp. 463-475.e6, Mar. 2022.

小川 未真(おがわ みま)
株式会社日立製作所 研究開発グループ
